ИССЛЕДОВАНИЕ МОЧИ. Собирание материала. Для общего анализа утреннюю мочу собирают в чистую сухую стеклянную посуду. Во избежание ошибочных толкований результатов исследований при попадании в мочу менструальной крови или гнойных влагалищных выделений у женщин мочу следует брать с помощью катетера. Для бактериологического исследования берут также утреннюю мочу в стерильную посуду; у женщин — обязательно катетером.
Количество мочи. Здоровый взрослый человек за сутки выделяет в среднем 1500—2000 мл мочи. В условиях же патологических количество суточной мочи может зачительно отклоняться от нормы.
Прозрачность мочи. Моча здорового человека выделяется прозрачной. При стоянии в ней может выпасть небольшой облачный осадок, который диагностического значения не имеет. Более значительные осадки могут образоваться от выпадения аморфных фосфатов в щелочной моче (белый осадок, растворяющийся при добавлении к нему какой-либо кислоты), аморфных уратов в кислой моче (красноватый осадок, растворяющийся при нагревании или при добавлении едкой щелочи), от кристаллических солей, гноя, крови, клеток эпителия, большого количества слизи и бактерии.
Цвет мочи. Нормальная моча имеет соломенно-желтый цвет. При увеличении количества мочи цвет ее становится бледнее, при уменьшении — темнее. Это зависит от изменения концентрации растворенных в ней веществ, которые дают ей окраску (урохромов). Примесь крови придает моче различной интенсивности красноватый цвет («цвет мясных помоев»), при больших количествах разложившегося кровяного пигмента моча приобретает коричневый цвет. Желчные пигменты окрашивают мочу от зеленовато-желтого до коричневого цвета. При встряхивании такой мочи образуется пена желтого цвета. При значительной примеси уробилина моча имеет цвет темного пива; желтой пены при этом не образуется.
Запах. Некоторое диагностическое значение имеет «фруктовый» запах мочи при выделении с ней значительного количества ацетона (сахарный диабет, голодание).
Удельный вес мочи отражает концентрацию растворенных в ней плотных составных частей и находится в прямой зависимости от количества выделяемой мочи. В нормальных условиях при увеличении количества мочи удельный вес ее понижается, при уменьшении — увеличивается, давая колебания в пределах 1012—1025. Признаком глубокого нарушения концентрационной способности почек является приблизительно одинаковый удельный вес (около 1010) всех порций суточной мочи. •
Для определения удельного веса мочи пользуются парными ареометрами-урометрами. На тонкой части каждого из них имеется шкала с делениями: у первого — от 1000 до 1025; у второго — от 1025 до 1050.
В мочу, налитую в цилиндр, погружают сначала урометр со шкалой от 1000 до 1025. Если урометр погрузится до какого-либо деления шкалы, то по этому делению отмечают в анализе удельный вес. Если же нижнее деление (1025) окажется при этом выше уровня мочи, берут второй урометр и по его шкале определяют более высокий удельный вес. Урометр дает правильные показания при температуре 20°. При иной температуре вносят поправки: на каждые 3° выше 20 прибавляют одно деление, на каждые 3° ниже 20 убавляют одно деление шкалы урометра.
Реакция мочи. При нормальном смешанном питании моча имеет слабокислую реакцию. Преобладание в диете мяса и злаков повышает кислотность мочи, при обилии овощей моча становится нейтральной или слабо щелочной. Кислая моча может изменить свою реакцию на щелочную при хранении в теплом помещении. Реакцию определяют с помощью полосок синей и красной лакмусовой бумаги.'Если смоченная мочой синяя полоска изменит свой цвет на красный, — реакция кислая; при щелочной реакции красная полоска становится синей. Реакцию мочи можно выразить при помощи водородного числа (рН), которое отражает концентрацию водородных ионов. Для этого надо иметь универсальную индикаторную бумагу, выпускаемую рижской конторой треста «Союзреактив». В упаковке помещены полоски фильтровальной бумаги, пропитанные индикатором; на внутренней стороне самой упаковки помещена цветная шкала, в которой каждый цвет соответствует целому числу рН от 1 до 10. Полоску бумаги смачивают исследуемой мочой и затем цвет ее сличают с цветом того или иного участка шкалы и таким образом определяют водородное число: рН = 7 указывает на нейтральную реакцию, числа ниже 7 — на кислую, выше 7 — на щелочную, рН нормальной (слабокислой) мочи колеблется в пределах от 5,3 до 6,5, т. е. цвет индикаторной бумажки будет приближаться к цвету шкалы, обозначенному числом 6.
Химические исследования мочи. Белок. В нормальной моче белок обычными лабораторными пробами не определяется, хотя и содержится в ничтожных количествах. Белок в моче находится в растворенном состоянии и определяется путем осаждения из раствора в виде мути или хлопьев. ^Щелочную мочу предварительно подкисляют до ясно кислой реакции добавлением в пробирку 1—2 капель 10% раствори уксусной кислоты. Если моча мутная, ее перед исследованием фильтруют через бумажный фильтр до прозрачности. Результаты реакции наблюдают на черном фоне, держа пробирку против света.
Проба с кипячением Наливают Vs пробирки мочи, подкисляют уксусной кислотой и кипятят на огне. При наличии белка появляется муть или белый хлопьевидный осадок.
Проба с с у л ь ф о с а л и ц и л о в о й кислотой. В пробирку наливают 3—5 мл профильтрованной мочи и добавляют 10 капель 10% водного раствора сульфосалициловой кислоты. Белок выпадает в виде мути или осадка. Эта проба является одной из самых чувствительных и открывает белок в количестве 0,015%о (pro mille).
Кольцевая проба с азотной кислотой. В качестве реактива приготовляют 50% раствор концентрированной азотной кислоты в воде или 5% раствор ее в насыщенном растворе поваренной соли.
Ход определения. В узкую пробирку пипеткой с резиновым баллончиком наливают на высоту 1 см реактив. Затем, держа пробирку наклонно, другой пипеткой медленно наслаивают 2—3 мл мочи, стараясь не смешать обе жидкости. Имеющийся белок выпадает в виде беловатого кольца в нижнем слое мочи на границе с реактивом. Толщина и время появления кольца зависят от количества белка. Если в течение 3 минут кольцо не образуется, дается отрицательный ответ. Установлено, что при содержании белка в количестве 0,033 г в 1 л (0,033%) тонкое, нежное колечко появляется к концу 3-й минуты. Это используют для количественного определения белка.
Определение количества белка. Метод определения состоит в том, что мочу, содержащую белок, последовательно разводят водой, и с каждым разведением делают кольцевую пробу с азотнокислым реактивом (см. выше). Разведения делают до тех пор, пока с последним из них не получают колечка к исходу 3-й минуты. Зная, что это время появления кольца соответствует содержанию 0,033 г белка в 1 л жидкости, достаточно умножить 0,033 на степень разведения, чтобы получить количество белка в исследуемой моче.
П р и м е р: кольцо к исходу 3-й минуты получено в моче, разведенной в 15 раз.
0,033%о X 15 = 0,495%о (округляем до 0,5%«).
Если в качественной пробе с азотной кислотой в неразведенной моче получают кольцо к концу 3-й минуты, отмечают, что моча содержит 0,033%о белка, и разведений не делают.
В тех случаях, когда проба с сульфосалициловой кислотой дает небольшое помутнение, а с азотной кислотой кольцо за 3 минуты не образуется, оценивают количество белка как «следы» (между 0,015 и 0,033%о).
Разведения делают в тех случаях, когда кольцо появляется тотчас же или ранее 2'/г минут.
При кольцевой пробе учитывают только кольца молочно-белого цвета, расположенные в самом нижнем слое мочи на границе с реактивом. Белая муть, появляющаяся иногда в верхних слоях, и цветные кольца в расчет не принимаются, так как они зависят от иных составных частей мочи. Для разведений в пределах первого десятка берут 1 мл мочи и добавляют столько миллилитров воды, сколько недостает до числа, выражающего нужную степень разведения. Примерные соотношения мочи и воды при разведениях: в 2 раза 1 + 1; в 4 раза 1 + 3; в 7 раз 1 + 6 и т. д.
Для разведений, больших десятикратного, исходным материалом служит моча, разведенная в 10 раз (1+9). Чтобы из нее сделать разведения в 20, 25, 50, 100 раз, к 1 мл десятикратного разведения добавляют 1; 1,5; 4; 9 мл воды. Таким же образом разведения порядка выше 100 делают из стократного разведения, свыше 1000 — из тысячекратного.
Определение виноградного сахара (глюкоза, декстроза). Выделение с мочой виноградного сахара носит название глюкозурии. У здоровых людей может встречаться временная, быстро проходящая глюко-зурия. Постоянная и нарастающая глюкозурия наблюдается при нелеченом сахарном диабете.
Если моча содержит белок, ее перед исследованием на сахар подкисляют 10% раствором уксусной кислоты до кислой реакции, кипятят и по охлаждении фильтруют через бумажный фильтр.
Качественное исследование. Проба на карамелизацию. В пробирку наливают 3—4 мл мочи и добавляют 15—20 капель 10% раствора едкого кали или едкого натра и осторожно нагревают жидкость на огне спиртовой или газовой горелки, начиная сверху, до кипения. Пробирку держат наклонно, отвернув отверстием в сторону (при бурном вскипании жидкость может быть выброшена из пробирки). При наличии в моче сахара жидкость приобретает буро-коричневый цвет, интенсивность которого пропорциональна содержанию сахара. Это может быть использовано для количественного определения глюкозы (см. ниже).
Проба Гайнеса, видоизмененная Акимовым. Реактивы:
1) 13,3 г чистой кристаллической сернокислой меди растворяют в 400 мл дистиллированной воды;
2) 50 г едкого кали растворяют в 400 мл воды;
3) 15 г глицерина разводят в 200 мл воды.
Смешивают два первых раствора и сейчас же добавляют третий. Хранят в склянке темного стекла. В пробирку наливают 3—4 мл реактива, прибавляют 8—12 капель мочи и кипятят так же осторожно, как при пробе на ка-рамелизацию (см. выше). Если в моче сахара нет, первоначальный синий цвет реактива не изменяется; если же сахар имеется, в пробирке образуется осадок от коричневато-зеленого до красного цвета (зависит от количества сахара).
Количественное определение сахара. Наиболее точное определение количества глюкозы (в процентах) делается при помощи поляриметра (наставление см, в специальных руководствах). Если поляриметра нет, можно применить простой, достаточно точный метод Альтгаузена.
Готовят ряд стандартных разведений глюкозы в моче. Для этого 1 г чистой глюкозы растворяют в 25 мл любой свежей бледно окрашенной, не содержащей сахар и белка мочи. Из этого основного (4%) раствора в пробирках с одинаковым диаметром делаюг разведения с той же мочой, не содержащей сахара:
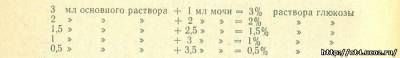
В б-ю пробирку отмеривают 4 мл основного (4%) раствора. На пробирках обозначают проценты содержащейся глюкозы. В каждую из пробирок добавляют по 1 мл 10% раствора едкого кали или едкого натра и все вместе помещают в кипящую водяную баню на 1 минуту.
При кипячении со щелочью сахар крамелизируется и окрашивает жидкость в бурый цвет — от светлого до темно-коричневого, в зависимости от концентрации раствора. Таким образом получается ряд пробирок с различной по интенсивности окраской. Исследуемую мочу в количестве 4 мл наливают в такую же пробирку, добавляют 1 мл 10% раствора едкой щелочи и также помещают на 1 минуту в кипящую воду. Через 10 минут, когда отстоится солевой осадок, сравнивают цвет исследуемой мочи с цветом жидкостей в стандартных пробирках и по совпадению интенсивности окраски с какой-либо стандартной пробиркой отмечают процент содержания сахара. Стандартные растворы годны на 1—2 суток. С них можно зарисовать акварелью полоски соответствующего цвета и интенсивности на таблицу, которая будет служить постоянным стандартом.
Ацетоновые тела. Ацетоновые тела (ацетон и ацетоуксусная кислота) выделяются с мочой, так же как и сахар, при сахарном диабете.
Проба Лапге. К 12—15 мл мочи добавляют 1 мл ледяной или 80% уксусной кислоты. Отдельно в другой пробирке растворяют несколько кристаллов нитропруссидного натрия в небольшом количестве дистиллированной воды и 0,5 мл этого раствора добавляют в первую пробирку и перемешивают. Потом в ту же пробирку осторожно наслаивают сверху 2 мл тройного аммиака.
При положительном результате на границе жидкостей образуется фиолетовое кольцо. Скорость появления и интенсивность окраски кольца пропорциональны содержанию ацетоновых тел. При малом их количестве кольцо появляется через несколько минут.
Определение кровяного пигмента. Присутствие крови в моче обычно выявляют при микроскопическом исследовании осадка, в котором находят неизмененные или выщелоченные эритроциты (гематурия). Реже, при отсутствии эритроцитов в осадке, находят растворенный в моче кровяной пигмент с помощью химических исследований (гемоглобинурия).
Проба с бензидином. Реактивы: 1) 0,3 г бензидина, растворенные в 100 мл 50% уксусной кислоты; 2) свежая перекись водорода (лучше делать из пергидроля, разводя последний в дистиллированной воде в отношении 1 + 10).
В пробирку последовательно наливают: 3 капли раствора бензидина, 3 капли перекиси водорода и 1 мл мочи. При наличии кровяного пигмента смесь в пробирке окрашивается в зеленый или синий цвет. Реакция очень чувствительна.
Проба амидопирином. Реактивы: 1) 5 г амидопирина, растворенные в 100 мл 96° спирта; 2) свежая перекись водорода (см. предыдущую пробу); 3) 50% раствор уксусной кислоты.
К 3 мл мочи добавляют 15 капель уксусной кислоты, 3 мл раствора амидопирина и 15 капель перекиси водорода. При положительной реакции появляется сиренево-фиолетовая окраска.
Определение желчных пигментов. Желчные пигменты (билирубин и биливердин) находят в моче при механических и некоторых паренхиматозных желтухах, когда содержание билирубина в крови увеличивается. При гемолитических желтухах, несмотря на увеличение содержания билирубина в крови, в моче он не определяется, что и служит отличительным признаком этого типа желтух. Моча, содержащая желчные пигменты, окрашена в зеленоватый или бурый цвет; при взбалтывании ее в пробирке образуется пена желтого цвета.
Проба Гмелина. Реактив: азотная кислота с примесью азотистой, В пробирку наливают 3—5 мл концентрированной азотной кислоты, бросают в нее кусочек дерева (обломок спички) и кипятят до появления бурых паров. Часть этой кислоты пипеткой переносят в чистую пробирку и, держа пробирку наклонно, наслаивают 1—2 мл мочи (как при определении белка). В присутствии желчных пигментов в нижнем слое мочи на границе с кислотой появляется кольпо зеленого цвета.
Проба Розина. Реактив: 1% спиртовой раствор йода. Можно приготовить из обычной 5% йодной настойки путем разведения 1 объема ее в 4 объемах чистого спирта. На мочу, налитую в пробирку, осторожно наслаивают реактив. При наличии желчных пигментов в верхнем слое мочи на границе с реактивом образуется зеленое кольцо. В той и в другой пробе иногда появляются кольца иных цветов. Они в расчет не принимаются.
Определение уробилина. В нормальной моче содержание уробилина настолько мало, что он обычными лабораторными пробами не определяется.
Количество уробилина значительно увеличивается при многих заболеваниях печени, пернициозной анемии, крупозной пневмонии, рассасывании кровоизлияний и при некоторых инфекционных заболеваниях, повышающих распад эритроцитов (сепсис, ревматический эндокардит и др.). Если в моче имеются желчные пигменты, их перед исследованием на уробилин надо из мочи удалить, так как они будут мешать ходу анализа. Для этого надо к 4 объемам мочи добавить 1 объем 10% раствора хлористого кальцмя и аммиака до ясно щелочной реакции. Выпавший осадок отфильтровать, реакцию производить с фильтратом.
Проба Флоранеа. В пробирку наливают 10—12 мл мочи и подкисляют ее 5—6 каплями крепкой серной кислоты, закрывают пробирку резиновой пробкой и несколько раз переворачивают. Разогревшейся при этом моче дают охладиться, затем добавляют 4—5 мл серного эфира и снова, закрыв пробкой, пробирку катают по столу. В это время уробилин переходит в эфир. Потом пробирку ставят в штатив и дают эфиру собраться над мочой. В другую пробирку наливают несколько миллилитров крепкой соляной кислоты и пипеткой наслаивают на нее эфирную вытяжку. Если количество уробилина повышено, на границе двух жидкостей образуется красное кольцо, скорость появления и интенсивность окраски которого будут пропорциональны количеству уробилина.
Определение и н д и к а н а. Индикан — один из конечных продуктов расщепления белков пищи; он выводится с мочой здоровых людей в малых количествах, которые обычными лабораторными пробами не определяются. Количество его увеличивается при усилении процессов брожения и гниения в кишечнике.
Проба Яффе. В пробирку к 5—6 мл мочи добавляют равный объем крепкой соляной кислоты, 3 капли 2% водного раствора марганцовокислого калия и 2—3 мл бензина или хлороформа. Закрыв пробирку пробкой, несколько раз переворачивают ее, а затем ставят в штатив. При этом бензин булет собираться в верхней части жидкости, хлороформ же как более тяжелый— оседать на дно пробирки.
При наличии повышенного количества индикана бензин и хлороформ приобретут синий цвет, по интенсивности которого можно расценить степень реакции (следы, слабо положительная, положительная, резко положительная и т. п.).
Микроскопическое исследование осадка. Пипеткой с резиновым баллоном со дна посуды собирают осадок отстоявшейся мочи и переносят его в пробирку для центрифугирования. Центрифугируют от 3 до 10 минут в зависимости от числа оборотов центрифуги, быстрым опрокидыванием пробирки сливают мочу, а из капли осадка делают нативный (необработанный) препарат на предметном стекле, покрыв каплю сверху тонким покровным стеклом. Можно микроскопировать и без покрытия, размазав каплю толстым слоем по стеклу, но такие препараты быстро высыхают.
Препараты микроскопируют сначала с малым увеличением (объектив 8Х, окуляры 7Х или 10Х), определяя и учитывая более крупные составные части осадка, затем переходят к большему (объектив 40Х, окуляры те же).
Неорганизованные (солевые) осадки мочи. С мочой в растворенном состоянии выделяется ряд конечных продуктов обмена веществ, уже ненужных и даже вредных для организма. При стоянии и охлаждении мочи часть из этих продуктов может выпасть в осадок в виде аморфных или кристаллических солей. Количество и качество солевого осадка зависят от ряда причин, не имеющих отношения к патологии (характер питания, удельный вес мочи, реакция ее, степень охлаждения и др, поэтому солевой осадок из нормальных составных частей мочи большого диагностического значения не имеет. Лишь находки патологических продуктов обмена могут помогать диагностике.
Осадки кислой мочи.
1. Аморфные ураты (соли мочевой кислоты) — осадок окрашен в желтоватый или красноватый цвет, растворяется при подогревании, не растворяется при добавлении кислот. При мнкроскопировании имеет вид мелких, слегка окрашенных зерен.
2. Мочевая кислота — кристаллы желтого цвета в форме табличек, бочек, снопов. Нередко образуют сростки — друзы. Растворимы в 10% едкой щелочи.
3. Оксалаты (соли щавелевой кислоты) — бесцветные или слегка желтоватые, преломляющие свет кристаллы, формой напоминающие почтовые конверты или бисквиты.
4. Фосфорнокислый кальций — бесцветные клиновидные кристаллы. Часто образуют сростки в виде пучков и розеток.
5. Сернокислый кальций — тонкие бесцветные кристаллы в виде игл или длинных брусочков. Часто собираются в пучки и розетки. Не растворимы в крепких кислотах (серной, соляной).
Осадки щелочной мочи. 1. Аморфные фосфаты (соли фосфорной кислоты)—осадок беловатого или сероватого цвета. От примеси кровяного пигмента может приобрести сходство с аморфными уратами, но в отличие от последних не растворяется при нагревании и легкорастворим в кислотах. При мнкроскопировании видны мелкие неокрашенные зерна.
2. Трипельфосфаты — бесцветные кристаллы, похожие на крышки гробов; растворимы в кислотах.
3. Мочекислый аммоний — желтого цвета шаровидные кристаллы с отростками в виде шипов. Растворимы и в кислотах, и в щелочах.
4. Нейтральная фосфорнокислая известь — бесцветные, плоские, продолговатые кристаллы, иногда с косо срезанными концами. Растворимы в уксусной кислоте.
5. Углекислый кальций — бесцветные шаровидные кристаллы, иногда парные. Растворимы в уксусной кислоте с образованием пузырьков углекислога газа.
Осадки, встречающиеся только при патологии.
1. Гематоидин (продукт изменения гемоглобина) —мелкие тонкие кристаллики продолговатой формы красноватого цвета. Встречается в моче, богатой выщелоченными эритроцитами, при нефритах и опухолях почек.
2. Холестерин — кристаллы имеют форму бесцветных четырехугольных тонких пластинок, иногда с обломанными уголками или с гранями в виде ступенек лестницы. Нередко, накладываясь друг на друга, они образуют характерные «слоеные» друзы.
3. Билирубин — кристаллы напоминают кристаллики гемотоидина, но окрашены в желтоватый или более светло-красный цвет. Встречаются в моче, богатой желчными пигментами.
4. Лейцин — шаровидные кристаллы желтого цвета с выраженной концентрической слоистостью и несколькими радиальными черточками, что придает кристаллам сходство с распилом треснувшего дерева.
5. Тирозин — нежные, блестящие игольчатые кристаллы желтоватого цвета, складывающиеся снопами или звездочками.
Лейцин встречается вместе с тирозином при тяжело протекающих заболеваниях печени, при неукротимой рвоте беременных и при некоторых инфекциях.
Организованные осадки мочи.
1. Эпителий: клетки эпителия, кроме почечного, являются нормальной составной частью осадка. Клетки плоского эпителия имеют небольшое ядро и широкую многоугольную цитоплазму. Большое количество их находят в женской моче, собранной без катетера (со слизистых наружных половых органов). Клетки эпителия моче-выводящих путей, различной величины и очертаний, мельче клеток плоского^ эпителия, но в отличие от последних ядра их удельно больше, а цитоплазма уже. Большое число их в осадке вместе с увеличенным количеством лейкоцитов говорит о воспалительном процессе на протяжении мочевыводящих путей. Клетки почечного эпителия— мелкие, круглые, с небольшим ядром в виде пузырька. При белковом и жировом перерождении зернисты. Встречаются в белковой моче вместе с цилиндрами только при заболеваниях почек.
2. Эритроциты в ничтожном количестве (единичные в препарате) могут встречаться в моче здоровых людей, например после тяжелой физической работы. В большом числе они встречаются при заболеваниях почек и мочевыводящих путей. При кровотечениях из мочевыводящих путей выделяются неизмененные, окрашенные в желтый цвет эритроциты; при гематуриях почечного происхождения они теряют гемоглобин и имеют вид неокрашенных колечек различной величины, часто меньше обычной (выщелоченные эритроциты). Следует учитывать, что при долгом стоянии мочи щелочной реакции или низкого удельного веса эритроциты также могут терять пигмент и симулировать эритроциты почечного происхождения.
3. Лейкоциты в нормальной моче можно обнаружить до 2—3 в поле зрения.
4. Мочевые цилиндры формируются в почечных канальцах и представляют собой удлиненные, прямые или изогнутые образования различной длины и ширины с закругленными или обломанными концами. На них могут быть наслоения из солей, эритроцитов, лейкоцитов, клеток эпителия и др.
Различают цилиндры: а) гиалиновые — бесцветные, стекловидные; б) вос-ковидные — более длинные и широкие, чем гиалиновые, непрозрачные, окрашенные в желтоватый цвет; в) эпителиальные, — состоящие из клеток почечного эпителия, иногда наслоенных на гиалиновый цилиндр; г) зернистые, — покрытые зернистым распадом белково перерожденных клеток почечного эпителия; д) жирнозерннстые — с блестящими жировыми капельками на поверхности; е) кровяные, — состоящие из эритроцитов.
Бактериоскопическое исследование. Из бактерий, встречающихся в моче, особое диагностическое значение имеют туберкулезные палочки и гонококки Нейсера, а также грибок Candida*
Из осадка делают мазки на хорошо обезжиренных предметных стеклах, сушат на воздухе и фиксируют троекратным проведением через пламя спиртовой горелки, держа стекло мазком кверху. Технику окраски туберкулезной палочки см. Исследование мокроты.
Исследование на гонококка и грибок Candida. Гонококки имеют вид двойных кокков бобовидной формы, расположенных внутри лейкоцитов, на клетках эпителия или межклеточно. Гонококки и грибок Candida окрашиваются 1% водным раствором метиленового синего (в течение 1 минуты) в синий цвет. По отношению к окраске по Граму гонококк является грамотрицательным и окрашивается в дополнительный — красный цвет, что и служит главным отличием его от других диплококков, сходных с ним по форме. Грибок Candida окрашивается по Граму в основной — темно-фиолетовый цвет (грамположительный).
Кроме осадка мочи, гонококков ищут в мазках из выделений мочеиспускательного канала, канала шейки матки, влагалища, заднего прохода и конъюнктивы глаз.
Грибок Candida состоит из толстого ветвящегося мицелия и мелких дрожжевидных почкующихся бластоспор.
Окраска по Граму.
1. Готовят впрок красящие бумажки. Растворяют 2 г генцианвиолета, метилвиолета или кристалвиолета в 100 мл 96° спирта и добавляют 5 г глицерина. Этим раствором хорошо пропитывают листки фильтровальной бумаги, положенные на стекло, и дают им высохнуть. Затем бумагу разрезают на полоски размерами уже и короче предметного стекла. Хранят в закрытой баночке.
2. Приготовляют раствор Люголя: 1 г йода, 2 г йодистого калия на 300 мл дистиллированной воды.
3. Фуксин Пфейффера: разводят фуксин Пиля (см. Исследование мокроты. Бактериоскопическое исследование) в 10 раз водой.
На фиксированный препарат кладут полоску красящей бумаги (1), смачивают ее несколькими каплями дистиллированной воды, прокатывают стеклянной палочкой или пробиркой, чтобы удалить из-под бумаги воздух, и оставляют па 1 минуту. Затем снимают бумажку, слегка споласкивают препарат водой и наливают раствор Люголя (2). Через 1 минуту раствор сливают, а препарат обесцвечивают в стаканчике со спиртом до тех пор, пока с пего не перестанет отходить краска (несколько секунд). Споласкивают водой и заливают на 1—2 минуты краской Пфейффера (3), смывают водой, сушат и микроскопируют с иммерсионным объективом.
Исследование выделений женских половых органов на присутствие трихомонад. Тонкие мазки из выделений фиксируют на огне и окрашивают 1% водным раствором метиленового синего в течение 1—2 минут, смывают водой, сушат и микроскопируют с иммерсионным объективом.
Трихомонады отличаются от окружающих их лейкоцитов и эпителиальных клеток малыми ядрами (по отношению к цитоплазме) характерной удлиненной овальной или клиновидной формы. Цитоплазма нередко вакуолизиро-вана и содержит в вакуолях бактерий. Более яркие препараты можно получить, зафиксировав и окрасив их как мазки крови для лейкоцитарной формулы (см. Приготовление мазков крови). В таких мазках можно видеть жгутики, окрашенные в красноватый цвет.
ИССЛЕДОВАНИЕ МОКРОТЫ НА ТУБЕРКУЛЕЗНЫЕ ПАЛОЧКИ И ЭЛАСТИЧЕСКИЕ ВОЛОКНА. Мокроту собирают в чистые, сухие, плотно закрывающиеся баночки. В мокроте не должно быть посторонних примесей, особенно пищевых частиц. Лучше собирать утреннюю мокроту, причем больной, проснувшись, прежде всего должен почистить зубы, хорошо прополоскать полость рта и глотку и после этого собирать мокроту до завтрака. Если у больного мокрота выделяется только по ночам, туалет полости рта надо делать на ночь.
Полученную для исследования мокроту наливают тонким слоем на 1—2 чашки Петри и на фоне сначала черной, затем белой бумаги тщательно просматривают и с помощью препаровальных игл или остро заточенных деревянных палочек выбирают из нее наиболее гнойные частицы и частицы, отли чающиеся цветом и плотностью от окружающего гноя. Отобранный материал исследуют в нативном препарате под покровным стеклом. Эластические волокна хорошо видны уже при малом увеличении. Они чаще всего встречаются в виде резко преломляющих свет тонких нитей, составляющих беспорядочные сплетения и пучки. При большом увеличении заметно, что толщина их одинакова на всем протяжении, концы их часто закругленно изогнуты. Если мокроту на предметном стекле предварительно смешать с 1—2 каплями 1% спиртового раствора эозина, то они в отличие от волокон растительного происхождения окрасятся в оранжево-красный цвет.
Эластические волокна попадают в мокроту при разрушении легочной ткани (туберкулез, гангрена, абсцесс и очень редко рак легкого).
Для исследования на туберкулезные палочки делают сухие окрашенные препараты. Из разных гнойных участков мокроты переносят частички на предметное стекло, ближе к одному концу. Затем, наложив на это стекло сверху другое, нажимая и растирая мокроту между стеклами, приготовляют два мазка, которые сушат, фиксируют на пламени горелки, окрашивают по методу Циля и Нильсена и микроскопируют с иммерсионным объективом.
Окраска по Цилю и Нильсену. Реактивы. 1. Фуксин Циля. В колбе емкостью 100 мл растворяют при нагревании 1 г основного фуксина в 15 мл 96° спирта и добавляют туда 100 мл ранее приготовленного 5% раствора карболовой кислоты.
2. 3 мл крепкой соляной кислоты растворяют в 100 мл 96° спирта.
3. 1 г метиленового синего растворяют в 100 мл дистиллированной воды.
На мазок накладывают полоску фильтровальной бумаги и обильно смачивают ее фуксином (1). Над огнем спиртовой горелки подогревают препарат до появления паров, дают остыть. Затем бумажку снимают пинцетом или иглой и прополаскивают препарат в стаканчике с раствором кислоты (2), где препарат постепенно обесцвечивается. Через 1—2 минуты препарат хорошо промывают водопроводной водой. Если мазок еще сохранил красный или розовый цвет, обесцвечивание повторяют. Наконец, препарат докрашивают 1 минуту 1% раствором метиленового синего (3), смывают водой и сушат. При микроскопировании туберкулезные палочки на общем синем фоне выделяются своим красным цветом.
ИССЛЕДОВАНИЕ МОКРОТЫ НА КАНДИДОЗ. Находки в мокроте больных мицелия и бластоспор грибка Candida — явления нередкие, но чаще всего они попадают в мокроту с пораженных полостей рта или глотки. Для исследования на Candida необязательно требуются окрашенные препараты, так как грибок хорошо виден и в натнвных. Его ветвящийся мицелий с бла-стоспорами по бокам и на концах очень напоминает ветви цветущей вербы или ивы.
ИССЛЕДОВАНИЕ ЖЕЛУДОЧНОГО СОКА. Для исследования секреторной деятельности желудка применяют одномоментный и фракционный методы получения желудочного содержимого. Первый метод не дает полной картины желудочной секреции, но он более прост и поэтому обычно применяется в амбулаторных условиях. Метод фракционного исследования сложный и трудоемкий, дает более ценные результаты и используется при детальном обследовании больных в стационарах. Для извлечения желудочного сока пользуются стерилизованными кипячением резиновыми зондами: при одномоментном взятии — толстым, при фракционном —тонким, без оливы. Через тонкий зонд содержимое отсасывают с помощью шприца емкостью 10 или 20 мл. Зондирование желудка противопоказано при аневризме аорты, тяжелом пороке сердца, высоком кровяном давлении и после недавнего желудочного кровотечения.
Пробный завтрак. При извлечении желудочного сока толстым зондом больному натощак дают завтрак из 50 г черствого белого хлеба или белых сухарей и 2 стаканов теплого некрепкого чая или теплой кипяченой воды.
При фракционном исследовании дают жидкий пробный завтрак: 1) 300 мл 5% раствора винного спирта или 2) 0,2 г чистого кофеина, растворенного в 400 мл воды. К этим жидкостям добавляют по 4—5 капель 0,5% раствора метиленовой синьки (по убыванию окраски в разных порциях извлекаемого сока судят о быстроте перехода жидкости из желудка в кишечник).
Взятие материала для фракционного исследования. Натощак вводят в желудок тонкий зонд до второй метки на нем, отсасывают и собирают для исследования все содержимое желудка. Не вынимая зонда, дают больному выпить весь пробный завтрак, после этого через каждые 10 минут извлекают шприцем по 10 мл желудочного содержимого и сливают каждую порцию в отдельную пробирку. Пробирки должны быть помечены порядковыми номерами и стоять в штативе. В первых порциях заметна постепенно убывающая голубая окраска, которая в какой-то порции исчезает. С этого момента желудочное содержимое извлекают еще в течение 1 часа также через каждые 10 минут и сливают в очередные пробирки. Содержимое каждой пробирки исследуют отдельно.
Физические свойства. Цвет. Нормальный желудочный сок бесцветен. Изменение цвета может быть от примеси крови или желчи. Свежая кровь, полученная в результате повреждения слизистых желудка и пищевода при зондировании, в соке, не содержащем соляной кислоты, сохраняет алый цвет; при наличии кислоты кровь приобретает бурый или коричневый цвет. Кровь, бывшая в желудке до зондирования, также имеет бурую окраску до цвета кофейной гущи.
Примесь желчи (забрасывание из двенадцатиперстной кишки) придает желудочному соку желтый (при ахилии) или зеленый (при наличии соляной кислоты) цвет.
Запах. При развитии в желудке процессов брожения и гниения (стеноз привратника) желудочное содержимое приобретает неприятный запах прогорклого жира или гнилостный.
Качественное химическое исследование. Реакция желудочного сока определяется лакмусовой или универсальной индикаторной бумажкой. В норме и при повышенной секреции она кислая, при ахилии — слабокислая, нейтральная или даже щелочная.
Свободная соляная кислота определяется красной бумажкой конго \ которая в присутствии свободной соляной кислоты меняет цвет на синий. Добавление к соку, содержащему кислоту, 1 капли 0,5% спиртового раствора ди-метиламидоазобензола дает красное окрашивание.
Молочная кислота образуется при брожении задержавшейся в желудке пищи, развивающемся в отсутствие соляной кислоты. Нередко обнаруживается при раке пилорического отдела.
Проба на молочную кислоту. В пробирку наливают 8—10 мл 1% раствора карболовой кислоты и добавляют 1 каплю 10% раствора полу-торахлористого железа. В полученную темно-фиолетовую жидкость каплями приливают фильтрованный желудочный сок. Если молочная кислота имеется, падающие на дно капли сока изменяют цвет жидкости в нижней части пробирки на зеленовато-желтый.
Кровяной пигмент определяется бензидиновым реактивом (см. Исследование мочи).
Желчные пигменты открываются теми же методами, что и в моче (см. Исследование мочи).
Количественное химическое исследование. Методом титрования децинор-мальным раствором едкого натра (0,1 н. NaOH) определяют в желудочном соке отдельно общую кислотность, свободную соляную кислоту и связанную соляную кислоту и выражают их числом миллилитров 0,1 н. едкой щелочи, необходимым для их нейтрализации в 100 мл желудочного сока.
Реактивы: 1) децинормальный раствор едкого натра; для его приготовления удобнее пользоваться готовыми ампулами фиксанала; содержимое ампулы с помощью воронки без потерь выливают в мерную колбу емкостью 1 л и добавляют дистиллированной водой до метки на шейке колбы; 2) 1 %
_______________________
1 Фильтровальную бумагу пропитывают 1% водным раствором краски конгорот, высушивают, разрезают на полоски.
спиртовой раствор фенолфталеина; 3) 0,5% спиртовой раствор диметилами-доазобензола; 4) 1% водный раствор ализариносульфоновокислого натрия.
Мои сайты
Библиотека (new)
LiveInternet
Статистика
Онлайн всего: 1
Гостей: 1
Пользователей: 0
 Cтарый 4емодан
Cтарый 4емодан

