ГЛАВА XIV
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
ОБЩИЙ АНАЛИЗ КРОВИ. Кровь для исследования рекомендуется брать утром натощак. Общий анализ крови состоит из определения количества гемоглобина (НЬ), числа эритроцитов (эр.) и лейкоцитов (л.) в 1 мм3 крови, вычисления цветного показателя, описания особенностей морфологии эритроцитов и подсчета лейкоцитарной формулы.
Нормальный состав крови взрослого человека. Гемоглобин (по гемометру ГС-2 и ГС-3): для женщин среднее значение 13,7 г% (грамм-процент), или 82% (единицы шкалы); колебания от 11,7 до 15,8 г%, или от 70 до 95% (единиц); для мужчин среднее значение 15,8 г%, или 95% (единиц); колебания от 13,3 до 18 г%, или от 80 до 108% (единиц).
Количество эритроцитов в 1 мм3: для женщин среднее значение 4 250 000; колебание от 4 000 000 до 4 500 000; для мужчин среднее значение 4 500 000; колебания от 4000 000 до 5 000 000, Цветной показатель 0,9—1,1. Количество лейкоцитов в 1 мм3 — 6000—8000.
Лейкоцитарная формула

Кровь для исследования берут из конца пальца, лучше из среднего левой руки, или из мочки уха. Кожу предварительно хорошо протирают ватными тампонами, смоченными сначала спиртом, затем эфиром. Поверхность кожи после такой обработки будет хорошо очищена, обезжирена, суха и выступающая из прокола капля крови не будет расплываться, что облегчит взятие крови.
Для прокола кожи ранее применяли иглу Франка, острие которой вместе с навинчивающейся муфтой дезинфицировали протиранием спиртом. Иглой Франка можно пользоваться при условии стерилизации ее прокаливанием острия и конца муфты на пламени спиртовой горелки в течение 3 минут. После прокаливания иглу следует погрузить на несколько секунд до поло-ьины муфты в кипяченую воду, стряхнуть остаток воды и дать инструменту остыть. Вместо иглы Франка рекомендуют пользоваться иглой-скарификатором со сменными копьями, которые стерилизуют кипячением. Описание устройства и способа пользования прилагается к каждому инструменту. В крайних случаях делать проколы можно иглами для шприца с условием очистки их мандренами и стерилизации кипячением перед повторными использованиями.
Первую каплю, выступающую из ранки, стирают тугим ватным тампоном, а из последующих набирают кровь в пипетки для постановки реакции оседания эритроцитов (РОЭ), для определения гемоглобина, в меланжеры (смесители) для счета лейкоцитов и эритроцитов и, наконец, делают мазки крови и препараты «толстой капли». Перед взятием каждой пробы старую каплю следует стирать тампоном, а кровь брать из свежевыпущенной капли.
Определение гемоглобина. Количество гемоглобина определяют при помощи гемометра, который представляет собой корпус-стойку с тремя вертикальными гнездами для пробирок и тремя смотровыми окнами. В задней стенке корпуса вмонтирована пластинка матового или молочного стекла. В два крайних гнезда помещены пробирки со стандартной окрашенной жидкостью; в среднее гнездо при исследовании вставляют одну из двух приложенных к прибору градуированных пробирок. В комплекте гемометра, кроме того, имеются две градуированные капиллярные пипетки с круговыми метками, определяющими объем взятой крови (20 мм3), пипетка-капельница, стеклянная палочка для перемешивания и резиновая трубочка с мундштуком.
Для работы необходимо иметь децинормальный раствор соляной кислоты и дистиллированную воду. Децинормальный раствор кислоты можно сделать из готовой ампулы фиксанала НС1, разведя содержимое ее в мерной колбе емкостью 1 л или отмерив в колбу из бюретки 8,2 мл чистой соляной кислоты удельного веса 1,19 и долив дистиллированной водой до метки на шейке колбы.
При исследовании пипеткой-капельницей наливают в градуированную пробирку раствор соляной кислоты до метки, соответствующей 2 г%. На градуированную пипетку надевают резиновую трубочку, берут мундштук в рот и из свежей капли насасывают кровь несколько выше метки, затем, вынув мундштук изо рта и держа пипетку горизонтально, ватным тампоном или фильтровальной бумагой стирают приставшую снаружи кровь и отнимают избыток крови, доводя уровень ее точно до метки. Конец пипетки погружают в верхний слой соляной кислоты в пробирке и осторожно выдувают в нее кровь, которая опускается на дно пробирки, оставляя верхний слой кислоты прозрачным. Не вынимая из кислоты, пипетку промывают повторными наса-сываниями и выдуваниями верхнего слоя жидкости. Пробирку встряхивают, вставляют в среднее гнездо корпуса и оставляют точно на 5 минут. За это время весь гемоглобин эритроцитов перейдет в раствор кислоты и превратится в солянокислый гематин, который изменит первоначально красный цвет жидкости на коричневый.
В дальнейшем в пробирку капельницей добавляют дистиллированную воду при постоянном перемешивании стеклянной палочкой до тех пор, пока цвет жидкости в градуированной пробирке не сравняется с цветом жидкости стандартных пробирок. При сличении цвета прибор держат на вытянутой руке на уровне глаз, обратив матовое стекло к источнику дневного света. Исследование при искусственном освещении дает неверный результат.
По шкале на пробирке определяют деление, до которого поднялся уровень жидкости (по нижнему уровню мениска), и цифрой, соответствующей этому делению, выражают количество гемоглобина.
В гемометрах, выпускаемых нашей промышленностью, за норму концентрации гемоглобина в крови здоровых людей принимается содержание 16,67 г гемоглобина в 100 мл крови, или 16,67 г%. Гемометр ГС-2 имеет две шкалы. Деления одной шкалы показывают количество гемоглобина в грамм-процентах, по делениям второй шкалы можно определить процент по отношению к нормальной концентрации (16,67 г%). Эти проценты называют еще единицами гемоглобина. Последняя модель гемометра ГС-3 имеет одну шкалу с обозначениями только грамм-процентов. Если же явится необходимость перевести показания гемометра на проценты (единицы), то количества найденных грамм-процентов следует умножить на 6. Например: определено гемоглобина 12,2 г%; 12,2 Хб = 73% (единицы). При этом десятые доли процентов до 5 отбрасываются, более 5 считаются за единицу.
При резко выраженном малокровии следует брать у больного не одну пипетку крови, а две (40 мм3) и полученный результат разделить на 2. Это уменьшает возможную ошибку. После каждого исследования пипетку промывают последовательно водой, спиртом и эфиром и сушат втягиванием через нее воздуха в резиновый баллончик. Пробирку промывают сначала водой, потом небольшим количеством децинормального раствора кислоты. Если работа закончена, достаточно промыть только водой. Во избежание выцветания стандартной жидкости гемометр следует хранить в футляре.
Взятие крови для счета эритроцитов и лейкоцитов. Для счета эритроцитов и лейкоцитов кровь набирают в смесители (меланжеры), в которых ее и разводят: для подсчета эритроцитов — 3% раствором хлористого натрия в 200 раз, для подсчета лейкоцитов — 3% раствором уксусной кислоты в 20 раз. Раствор хлористого натрия сохраняет форменные элементы крови, раствор уксусной кислоты обесцвечивает эритроциты, сохраняя для подсчета только лейкоциты.
Смеситель состоит из капиллярной пипетки с делениями 0,5 и 1 и расширенной ампулы, переходящей снова в капилляр, на котором имеются метки 101 или 11.
Для счета эритроцитов берут смеситель с меткой 101, для лейкоцитов — с меткой 11. Па верхний конец смесителя надевают резиновую трубочку с мундштуком и насасывают в капилляр кровь точно до метки 0,5, обтирают кончик капилляра от приставшей крови и затем вслед за кровью набирают соответствующую разводящую жидкость до метки 101 или 11. Кровь и жидкость надо набирать так, чтобы в ампуле не было пузырьков воздуха, которые изменяют правильное соотношение крови и жидкости и ведут к ошибке при счете.
Чтобы избежать образования этих пузырьков, необходимо после каждого исследования хорошо промывать смесители водой, спиртом и эфиром и сушить так же, как пипетку гемометра (см. выше). В хорошо высушенном смесителе стеклянная бусинка в ампуле при встряхивании свободно катается, не приставая к стенкам.
Набрав кровь и разводящую жидкость, снимают резиновую трубочку, зажимают концы смесителя между I и III пальцами и встряхивают в течение 2—3 минут, хорошо перемешивая содержимое ампулы. Имеющаяся в ампуле бусинка способствует этому.
Если подсчет форменных элементов производится не сразу или смесители требуют переноски в лабораторию, на них надевают кольца, сшитые из резиновой ленты, или трубки, чтобы герметически закрыть оба отверстия.
Счетная камера. Счет эритроцитов и лейкоцитов производят с помощью счетной камеры, которая представляет собой толстое предметное стекло, на верхней поверхности которого четырьмя поперечными канавками отграничены три поперечные пластинки. Поверхность средней из них на 0,1 мм ниже поверхностей двух крайних. На поверхности средней пластинки начерчены одна или две сетки. Если сеток две, то средняя пластинка разделена канавкой на две половины. Это позволяет считать одновременно две капли, не заполняя камеры вновь. На пластинки камеры накладывают специальное покровное стекло, так называемое шлифованное или плоскопараллельное, и пальцами притирают его к поверхностям двух крайних пластинок так, чтобы образовались радужные «ньютоновы кольца». Между поверхностью средней пластинки камеры, на которой нанесены сетки, и нижней поверхностью покровного стекла образуется щелевидная полость камеры высотой 0,1 мм.
Сетка представляет собой квадрат, разделенный вертикальными и горизонтальными параллельными линиями на ряд более мелких квадратов. Сетки бывают различные и называются по имени предложивших их авторов: Тома, Бюркера, Тюрка, Предтеченского, Горяева и др. Принцип всех сеток одинаков. В основу их положен малый квадрат, который во всех сетках имеет одинаковую площадь: 1/100 мм 1/200 мм = 1/400мм2. При высоте камеры, равной 1/100мм, каждому малому квадрату соответствует столбик жидкости, объем которого равен: 1/400 мм2 X 1/10 мм = 1/4000 мм3. Кроме малых квадратов, в сетках имеются большие, площадь которых равна площади 16 малых квадратов. Сетка Предтеченского состоит из 100, а сетка Горяева — из 225 таких больших квадратов. В той и в другой сетке чередуются большие квадраты, расчерченные вертикально и горизонтально на 16 малых квадратов, с квадратами, разделенными на полосы только горизонтальными или только вертикальными линиями, или, наконец, с чистыми квадратами, без линий.
Заполнение камеры. Концы смесителя зажимают между I и III пальцами и снова хорошо перемешивают содержимое ампулы встряхиванием в течение 3 минут, затем выпускают на сторону 1—2 капли жидкости из капилляра, чтобы удалить ту ее часть, которая не участвовала в перемешивании; вновь встряхивают смеситель в течение 1 минуты и снова выпускают из капилляра 1—2 капли смеси. Затем обтирают тряпочкой конец капилляра и, дав следующей капле нависнуть на нем, зажимают верхнее отверстие смесителя пальцем и подводят нависшую каплю к краю покровного стекла над средней пластинкой камеры. По закону капиллярности смесь устремляется в полость камеры и заполняет ее.
Капля должна быть такой величины, чтобы она заполнила всю полость камеры, не переливаясь, однако, в канавки и тем более не попадая под притертые части покровного стекла. В заполненной камере не должно быть пузырьков воздуха. Они образуются при загрязнении поверхностей камеры и покровного стекла жиром. Поэтому камеру и покровное стекло периодически следует мыть теплой водой с мылом. После каждого исследования их споласкивают водой и вытирают чистой мягкой тряпочкой.
Счет эритроцитов. Заполненную из смесителя с меткой 101 камеру кладут на горизонтальный предметный столик микроскопа и оставляют на 1 минуту, давая таким образом эритроцитам осесть на дно камеры. С наклонным столиком считать форменные элементы нельзя, так как они во время подсчета будут перемещаться и это приведет к большой ошибке. Сначала находят сетку с малым увеличением микроскопа (объектив 8 X, окуляр 7 X или 10 X), устанавливают камеру так, чтобы в центре поля зрения был виден угловой большой квадрат, разделенный на 16 малых квадратов, а затем переходят на большое увеличение (объектив 40 X). Считают эритроциты сначала в верхнем ряду малых квадратов, затем по очереди — в следующих трех. В каждом ряду из 4 малых квадратов подсчитывают все эритроциты, лежащие внутри него, и те, которые пересекаются левой и верхней границами полосы или прикасаются к ним с той или с другой стороны. Эритроциты, лежащие на правой и нижней границах и прилегающие к ним, не считают. Таким образом, при подсчете первой полосы эритроциты, касающиеся нижней границы, в счет не попадают, но они будут подсчитаны во второй полосе, когда нижняя граница первой полосы станет верхней границей второй полосы квадратов, и т. д.
Эритроциты, соприкасающиеся с нижней границей большого квадрата, не считаются, но число их компенсируется теми, которые были подсчитаны на верхней границе. Точно так же подсчет эритроцитов, соприкасающихся с левой границей большого квадрата, компенсируют отброшенные эритроциты, прилегающие к правой границе. Эритроциты, прилегающие к левому нижнему углу квадрата, считают, прилегающие к верхнему правому — отбрасывают.
Передвигая камеру по диагонали, подсчитывают таким же порядком эритроциты еще в 4 больших квадратах, разделенных на 16 малых. Числа эритроцитов, сосчитанные в каждом из 5 больших квадратов, записывают вертикальным столбиком и суммируют. Количество эритроцитов в 1 мм3 крови определяют по
формуле:
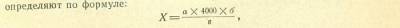
где: X — число эритроцитов в 1 мм3; а — число эритроцитов, подсчитанное в 5 квадратах; б — степень разведения крови; в — число подсчитанных нами малых квадратов.
Пример. При разведении крови в 200 раз в 80 малых квадратах (из которых каждому соответствует объем жидкости, равный 1/4000 мм3) нами подсчитано 425 эритроцитов.
Подставив В формулу вместо букв эти цифры, получаем:

Практически: к подсчитанному числу эритроцитов следует справа приписать четыре нуля.
Для большей точности следует считать эритроциты в двух разных каплях и результатом брать среднее арифметическое.
Счет лейкоцитов. Камеру заполняют из меланжера с меткой 11 кровью, разведенной раствором уксусной кислоты. Лейкоциты отчетливо видны на сетке даже при малом увеличении, которое и применяется при их подсчете (объектив 8 X, окуляр 10 X или 15 X).
Сосчитать надо лейкоциты, находящиеся в 50 больших квадратах. В сетке Предтеченского считают через одну 5 поперечных полос больших квадратов во всю ширину сетки (10 X 5 = 50). В сетке Горяева можно считать в разных местах 3 полные полосы квадратов (15 X 3 = 45) и еще 5 квадратов из какой-либо четвертой полосы или по 25 квадратов в двух противоположных углах сетки.
При подсчете соблюдают то же правило: лейкоциты, соприкасающиеся с левой и верхней границами полос квадратов, считают; лейкоциты, соприкасающиеся с правой и нижней границами, отбрасывают. Количество лейкоцитов, сосчитанное в 50 больших квадратах, подставляют в приведенную выше формулу.
Пример: в 50 больших, т. е. 800 малых, квадратах подсчитано 72 лейкоцита, кровь разведена в 20 раз.

Практически: к подсчитанному числу лейкоцитов приписывают справа два нуля. Подсчет лейкоцитов по одной сетке не обеспечивает точности. Следует считать в двух сетках и выводить среднее арифметическое.
Разведение крови в пробирках по Николаеву. Для взятия крови по этому способу необходимо иметь: серологические пробирки (ЮОХ 12 мм), две микрохимические пипетки на 2 мл с делениями по 0,1 мл, две пипетки от гемометра и обычные разводящие жидкости.
Для подсчета эритроцитов в пробирку отмеривают 4 мл 3% раствора хлористого натрия, в другую пробирку для подсчета лейкоцитов наливают 0,4 мл 3% раствора уксусной кислоты. В обе пробирки разными пипетками от гемометра вносят по 20 мм3 крови и промывают капилляры их жидкостями (как при взятии крови на гемоглобин). Заткнув отверстие пальцем в резиновом напалечнике, каждую пробирку несколько раз переворачивают, стараясь не образовать пены. В первой пробирке кровь будет разведена в 200 раз, во второй — в 20 раз, т. е. так же, как и в смесителях.
Перед заполнением камеры смесь в пробирке снова перемешивают, затем, держа пробирку наклонно, берут из нее оплавленной стеклянной палочкой каплю смеси и заполняют подготовленную камеру.
Цветной показатель. Степень насыщения эритроцитов гемоглобином выражают цветным показателем. Насыщенность эритроцитов гемоглобином в крови, имеющей 16,67 г% (100 единиц) гемоглобина и 5 000 000 эритроцитов, принята за единицу. В каждом анализе цветной показатель определяют по формуле:

_________________
1 Если число эритроцитов более 1000 000 в 1 мм3, берут первые две цифры этого числа, если меньше 1 000 000—одну первую цифру.
Морфологическое исследование крови. Приготовление мазков крови. В анализе крови, кроме показателей числа эритроцитов и лейкоцитов, большое значение имеет описание особенностей морфологии эритроцитов (величина, форма, окрашивание) и процентное содержание различных видов лейкоцитов. Для приготовления хороших мазков надо иметь шлифованное стекло с уголками, отрезанными или обломанными с таким расчетом, чтобы короткие ребра его были на 3—4 мм уже ширины обычного предметного стекла, и совершенно чистые обезжиренные предметные стекла. Для очистки и обезжиривания стекол их лучше всего помещать в толстостенную стеклянную банку с хромовой смесью (насыщенный раствор двухромовокис-лого калия в крепкой технической серной кислоте — аккумуляторной). Новые стекла кладут без предварительной обработки; со стекол же, бывших в употреблении, предварительно удаляют иммерсионное масло тампонами, смоченными какими-либо растворителями жиров: бензином, эфиром, толуолом и т. п. Держат стекла в смеси не менее суток, затем осторожно сливают смесь из банки в склянку с притертой пробкой, а стекла в банке заливают водой и оставляют на несколько часов. Воду осторожно сливают в раковину, ставят банку под водопроводный кран и сначала слабой струей воды, а затем более сильной, помешивая, промывают стекла 1—2 часа. Воду сливают, стекла по одному вынимают чистым пинцетом и, не касаясь пальцами рабочих поверхностей, держа их только за ребра, вытирают свежестираннсй тряпочкой. С хромовой смесью надо работать очень осторожно, так как даже разведенная водой, попав на кожу или слизистые, она может вызвать сильные ожоги.
При отсутствии хромовой смеси стекла кипятят в мыльном растворе или растворе бельевой соды, затем хорошо промывают сильной струей воды, заливают на 2—3 часа слабым раствором уксусной или соляной кислоты, вновь промывают водой и вытирают.
Мазки делают из свежих капель крови. Не прикасаясь к коже пальца, прикладывают к капле конец предметного стекла, затем, повернув стекло каплей кверху, подводят к ней узкий край шлифованного стекла, наклоненного по отношению к предметному под углом около 45°. Когда капля расплывается вдоль шлифованного стекла, движением по направлению к другому концу предметного стекла делают тонкий мазок.
Для каждого исследования следует делать по 2—3 мазка. На средней части каждого мазка простым (не химическим) карандашом пишут фамилию и инициалы больного, дату исследования.
Фиксация и окрашивание мазков. Мазки окрашивают водными растворами красок, но перед окраской их фиксируют. Лучшим фиксатором является чистый метиловый спирт (метанол). Несколько хуже фиксирует смесь Никифорова (спирт-ректификат 96° и наркозный эфир в равных объемах).
В крайнем случае можно пользоваться спиртом-сырцом 80°. Фиксирующую жидкость наливают в широкогорлые склянки с притертой пробкой на высоту предметного стекла. Мазки, сложенные попарно намазанными сторонами, кнаружи, чистым пинцетом погружают в жидкость и фиксируют: метанолом— 3—5 минут, смесью Никифорова—15—20 минут и спиртом-сырцом—» 5—10 минут.
Затем пинцетом же стекла вынимают, споласкивают дистиллированной водой и укладывают мазками кверху на мостик для окраски. Этот мостик делают из двух параллельно расположенных стеклянных трубок, палочек, скрепляя попарно концы их обрезками резиновой трубки или пластинками толстой резины с просверленными в них отверстиями. Ширина мостика должна быть на 2 см меньше длины предметного стекла. Окрашивание мазков производится водными растворами красок, в состав которых входят красители: азур и эозин. Эти краски очень чувствительны к реакции воды.
Чтобы добиться хорошей окраски мазков, необходимо и для разведения краски, и для смывания ее с мазков иметь дистиллированную воду нейтральной реакции. Обычно дистиллированная вода имеет слабокислую реакцию и ее приходится подщелачивать 1% раствором углекислой соды, реже под кислять 1% раствором уксусной кислоты.
При нейтральной реакции воды эритроциты окрашиваются в розово-желтый цвет; в ядрах лейкоцитов, окрашенных в красновато-фиолетовый цвет хорошо видно строение хроматина; нейтрофильная зернистость лейкоцитов имеет сиренево-фиолетовые тона, эозинофильная — красный, базофильная - темно-фиолетовый, почти черный цвет.
При кислой реакции эритроциты окрашиваются в красный цвет; ядра лейкоцитов очень бледны, структура неясная; нейтрофильная зернистость не окрашивается, эозинофильная — ярко-красная; тромбоциты почти не окрашиваются.
Если реакция воды будет щелочной, то эритроциты и эозинофильная зернистость примут грязно-коричневый цвет, ядра лейкоцитов будут выглядеть темными, бесструктурными; тромбициты — темно-фиолетовыми, с трудно различимым строением
Для определения годьости дистиллированной воды для окраски рекомендуется проба с краской гематоксилином. В два одинаковых химических стаканчика наливают поровну исследуемую воду и ставят стаканчики рядом на лист белой бумаги. Левый стаканчик будет служить контролем, в правый — бросают несколько кристалликов гематоксилина и замечают время. Вращательными движениями помешивают воду в правом стаканчике и на фоне бумаги сверху наблюдают изменения ее цвета. Если вода окрасится в розовато-сиреневый цвет не ранее 1 и не позднее 5 минут, она годна для окраски. Если вода не окрасится и по истечении 5 минут, она имеет кислую реакцию и ее следует подщелачивать. Если вода окрасилась ранее 1 минуты, — реакция щелочная, воду надо подкислять (это случается редко и зависит обычно от недостаточного или неправильного мытья посуды для воды).
Окрашивание мазков по Романовскому. Необходимо иметь краску азур-эозин по Романовскому (старое название — краска Гнм-зы). Для разведения этой краски в воде надо выделить специальную посуду— мензурку или стаканчик и пипетку-капельницу, и ни для какой иной работы их не употреблять. Мыть их можно только спиртом и дистиллированной водой. В мензурку наливают необходимое количество дистиллированной ьоды (4 мл на каждый препарат) и затем отмеривают пипеткой краску из расчета I'/г—2 капли на 1 мл воды. Хорошо перемешивают.
Зафиксированные тем или иным способом препараты кладут на мостик мазками кверху, наливают на них разведенную краску в таком количестве, которое способно, не сливаясь, удержаться на стеклах, и оставляют на 20 -30 минут. По окончании этого срока краску, не сливая, смывают с препарата струей дистиллированной воды и ставят стекла вертикально или слегка наклонно для просушивания.
Кроме окраски по Романовскому, можно применять некоторые другие методы, дающие очень хорошие результаты и отличающиеся тем, что в них окраска сочетается с фиксацией.
Метод Фил и пеон а. Делают смесь из 1 части краски Романовского и 3 частей 96е спирта. Нефиксированные сухие препараты кладут на мостик и наливают на них по 1 мл смеси на 1 1/2 минуты, затем, не смывая, добавляют каплями такое же количество дистиллированной воды и перемешивают ее с краской осторожными покачиваниями мостика. Красят 20—30 минут, смывают, сушат.
Окрашивание по П а п п е н г е й м у. Кладут сухие нефиксированные мазки на мостик, наливают на них пипеткой по 12—15 капель фиксатора-красителя типа Май-Грюнвальда.
Через 2—3 минуты добавляют каплями такое же число капель дистиллированной воды и перемешивают качанием мостика. Через 1 минуту смесь краски с водой, не сливая, смывают струей дистиллированной воды, оставшуюся на стеклах воду сливают, а на препараты наливают высоким слоем краску Романовского, разведенную в дистиллированной воде из расчета 1 1/2—2 капли краски на 1 мл воды. Красят 15—25 минут, смывают краску струей воды и сушат препараты. Эгот способ особенно хорошо выявляет структуры ядер и зернистости лейкоцитов.
Микроскопическое исследование мазков крови. дли изучения морфологии форменных элементов применяют иммерсионный объектив 90 X и окуляр 7 X или 10 X.
В тонких местах мазка, где форменные элементы располагаются по отдельности, изучают и описывают морфологию эритроцитов и вычисляют лейкоцитарную формулу. Следует обращать внимание и на количество встречающихся тромбоцитов, чтобы в случае малого числа их отметить в анализе это обстоятельство. В нормальной крови эритроциты имеют круглую форму и приблизительно одинаковые размеры (диаметр около 7 мю). Центр эритроцитов окрашен бледнее периферии. При анемиях различного происхождения размеры, форма и окраска эритроцитов могут изменяться. В анализе отмечают ту или иную степень гипохромии, когда большинство эритроцитов окрашено равномерно бледно или имеет большое просветление в середине. При резкой гипохромии эритроциты представляются в виде бледно окрашенных колец. Если же, наоборот, эритроциты окрашены интенсивнее обычного и не имеют центральных просветлений, то в анализе указывают степень гипер-хромии. При так называемой пернициозной анемии с высоким цветным показателем в мазках встречаются очень крупные гиперхромные мегалоциты, а при гемолитических анемиях находят мелкие темно окрашенные сфероциты.
Заметное разнообразие эритроцитов по величине называют анизоцитозом, В зависимости от преобладания эритроцитов более мелких или более крупных размеров отмечают в анализе анизоцитоз с микроцитозом или с макро-цитозом. При значительно выраженных анемиях в крови появляются пой-килоциты — эритроциты не круглой, а самой разнообразной формы.
В крови здоровых людей в небольшом числе (до 0,8%) встречаются эритроциты, окрашенные б отличие от большинства остальных в серовато-сиреневые или голубоватые тона. Такие формы носят название полихроматофи-лов. Они являются недозревшими, не полностью насыщенными гемоглобином эритроцитами. При анемиях количество их может значительно увеличиваться и подсчет их в таких случаях приобретает большое диагностическое значение. Но делают это не в обычных мазках крови, а в приготовленных по специальной методике (см. Ретикулоциты).
Ядерные формы эритроцитов. Безъядерные эритроциты крови человека образуются из ядросодержащих клеток костного мозга. В костном мозгу из самых молодых и больших клеток красной крови — проэритробластов — при созревании последовательно образуются эритробласты: базофиль-ные, полихроматофильные и оксифильные (с синей, серовато-голубой и, наконец, розово-желтой цитоплазмой).
Созревание эритроцита завершается освобождением клетки от ядра. В норме только эти безъядерные эритроциты вымываются из костного мозга в кровь, но при некоторых видах малокровия в кровь проникают и ядерные формы — эритробласты, что служит всегда признаком тяжелого нарушения кровотворения.
Одновременный счет ретикулоцитов и тромбоцитов по Н. Г. Алексееву.
В норме количество ретикулоцитов колеблется от 0,3 до 0,8%- Количество их резко увеличено при гемолитических анемиях, достигая при врожденных (семейных) формах 50—70%. При различных анемиях, в частности вызванных острыми и хроническими кровоиотерями, увеличение числа ретикулоцитов является благоприятным признаком активной реакции костного мозга. Наоборот, нормальный или недостаточный процент их указывает на малую активность костного мозга или на недостаточность метода лечения. Так, при специфическом лечении пернициозной анемии в первые же дни число ретикулоцитов должно значительно увеличиваться. Стойкое уменьшение числа ретикулоцитов, несмотря на достаточное лечение, наблюдается при гипопластических и апластических анемиях, иногда при острых лейкозах, тяжелой лучевой болезни.
Тромбоциты, или кровяные пластинки, являются третьим форменным элементом крови. Они образуются в костном мозгу из цитоплазмы гигантских клеток — мегакариоцитов.
По величине тромбоциты значительно меньше эритроцитов. Форма их различная: круглая, овальная или вытянутая. На голубом фоне тромбоцита видна разнообразная по количеству и величине частиц красно-вишневая зернистость. Количество их в 1 мм3 нормальной крови колеблется от 200 000 до 300 000. Тромбоциты играют большую роль в процессе свертывания крови, и уменьшение числа их ниже 30 000 в 1 мм3 ведет обычно к кровоточивости. Исключением является пернициозная анемия, при которой низкие числа тромбоцитов не приводят к кровоточивости.
Обычно подсчет ретикулоцитов и тромбоцитов проводят по двум различно приготовленным препаратам. Нами разработана и предложена методика, позволяющая производить подсчет тех и других элементов крови одновременно в одном препарате.
В колбу емкостью 100 мл отмеривают 45 мл дистиллированной воды, добавляют 5 г трехзамещенного лимоннокислого натрия* и 0,4 г хлористого натрия. После растворения солей добавляют 1 г краски азур II и на малом огне нагревают жидкость минут 10—15, не доводя до кипения. Затем ее нужно охладить до комнатной температуры и профильтровать через бумажный фильтр. Фильтрат будет служить рабочим раствором. В смеситель для белой крови набирают приготовленную краску до метки 1. Вслед за краской насасывают в смеситель кровь, свободно выступающую из широкого прокола пальца, приблизительно до 4Д объема ампулы смесителя. Быстро выдувают чистую кровь из капиллярной части смесителя на ватный тампон, а оставшуюся смесь крови с краской перемешивают выдуванием на часовое стекло и обратным насасываннем в смеситель (3 раза). Набрав последний раз смесь в смеситель, оставляют его на 20—30 минут в горизонтальном положении для окрашивания. После этого нужно перемешать смесь встряхиванием меланжера в течение 2 минут, слить 2 капли из капилляра, а из оставшейся части сделать очень тонкие мазки на предметных стеклах медленным движением шлифованного стекла (см. Приготовление мазков крови). Высохшие на воздухе мазки фиксируют, поместив 'на мостик для окраски и налив на них метанол на 3 минуты или спирт-сырец на 5 минут, или фиксатор типа Май-Грюнвальда на 3 минуты. Не сливая, смывают струей дистиллированной воды и докрашивают раствором краски Романовского в течение 30—45 минут (см. Окраска мазков крови). Эритроциты окрасятся в желто-розовый цвет, сетки ретикулоцитов — в синий, тромбоциты — в красно-фиолетовый.
Счет ретикулоцитов и тромбоцитов проводят одновременно, уменьшив поле зрения при помощи окуляра с «окошечком». Для этого следует отвинтить в обычном окуляре (7 X или 10 X) оправу верхней линзы и вложить внутрь его на диафрагму вырезанный из черной бумаги (упаковки фотопленок) кружок соответствующего диаметра с прорезанным в центре квадратом со сторонами длиной 2 мм и ввинтить оправу на место.
Передвигая препарат, подсчитывают в разных местах мазка 1000 эритроцитов, считая отдельно все встречающиеся ретикулоциты и тромбоциты. В результате количество ретикулоцитов нужно обозначить в процентах, а количество тромбоцитов — числом их в 1 мм3. Для последнего необходимо обычным путем (в камере) определить количество эритроцитов в 1 мм3 крови. Отбросив три нуля, умножить полученное число на количество тромбоцитов, подсчитанных по мазку.
Пример: при подсчете 1000 эритроцитов найдено: ретикулоцитов 24, тромбоцитов 71, эритроцитов в 1 мм3 3 250 000.
В ответе записать: ретикулоцитов 2,4%, тромбоцитов 230 750 в 1 мм3 (71/1000).
Техника счета лейкоцитарной формулы. Лейкоцитарная формула выражает в процентах содержание в крови лейкоцитов различных видов: базофнлов, эозинофилов, нейтрофилов, лимфоцитов, моноцитов. В группе нейтрофильных лейкоцитов отдельно подсчитывают клетки разной степени зрелости: миелоциты, юные (метамиелоциты), палочкоядерные и сег-
_______________________
1 Кислая соль лимоннокислого натрия для работы совершенно непригодна.
ментоядерные. Обычно считают 200 лейкоцитов, отдельно учитывая числа различных видов их, а полученные результаты делят на 2 и получают проценты. Только при резком уменьшении количества лейкоцитов (лейкопения) можно ограничиваться счетом 100 клеток.
Лейкоциты в мазках распределяются неравномерно: по краям преобладают нейтрофилы, в середине — лимфоциты, поэтому для получения сличимых результатов формулу следует считать по раз принятому порядку. Клетки лучше всего считать в 4 участках мазка — по два с каждой стороны: один в середине мазка, другой — ближе к концу (начало мазка бывает обычно слишком толстым, клетки там имеют неясную структуру). Подсчет ведут по зигзагу: 3—4 поля зрения по краю мазка, столько же под прямым углом к середине мазка, потом 3—4 поля параллельно краю мазка и снова возвращаются к краю. Таким порядком в каждом из 4 участков подсчитывают по 50 лейкоцитов.
Для регистрации лейкоцитов удобнее всего пользоваться специальным 11-клавишным счетчиком для лейкоцитарной формулы. При отсутствии счетчика можно записывать лейкоциты на листе бумаги, разлинованной в клетку. Обводят карандашом прямоугольник в 200 квадратиков (10X20) и при счете каждый лейкоцит записывают в отдельный квадратик начальной буквой его названия: б, э, ю, п, с, л, м Стараются, пока возможно, одинаковые клетки регистрировать столбиками (десятками) и только последние в счете лейкоциты разносят на свободные квадратики.
Лейкоцитарная формула дает только относительные величины (проценты), но не отражают абсолютного содержания лейкоцитов того или иного вида в одном объеме крови. Так, 30% лимфоцитов при общем количестве лейкоцитов, равном 6000 в 1 мм3, даст абсолютное содержание лимфоцитов, равное 1800 в 1 мм3 (30 умноженные на 60), что является нормальным числом, но те же 30% лимфоцитов при 3000 лейкоцитов составят только 900 лимфоцитов в 1 мм3, и это покажет значительное их уменьшение — лимфопению (см. Нормальный состав крови). Для определения абсолютных чисел надо проценты отдельных видов лейкоцитов умножать на число сотен общего количества лейкоцитов.
Индекс сдвига нейтрофильных лейкоцитов. В лейкоцитарной формуле здоровых людей в группе нейтрофилов преобладают наиболее зрелые формы — сегментоядерные (43—60%), значительно меньше более молодых — палочко-ядерных (2—5%); юные и миелоциты не встречаются. Но при некоторых заболеваниях, главным образом при инфекционных, в крови увеличивается процент палочкоядерных, к в том или ином проценте появляются юные и миелоциты. Это «омоложение» состава нейтрофилов называется сдвигом влево. Степень его иногда отражает тяжесть инфекции. Индекс сдвига можно определить по формуле:
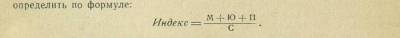
Мои сайты
Библиотека (new)
LiveInternet
 Cтарый 4емодан
Cтарый 4емодан

